Bạn đang xem bài viết Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9 tại Thcslytutrongst.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Muối, hay còn được gọi là hợp chất ion không hữu cơ, là một trong những loại chất rất phổ biến và quan trọng trong cuộc sống hàng ngày. Tính chất hoá học của muối đóng vai trò quan trọng trong nhiều quá trình tự nhiên và công nghiệp. Chúng được sử dụng rộng rãi trong các ngành công nghiệp thực phẩm, dược phẩm, hóa chất, và cả trong nhiều ứng dụng y học.
Muối có khả năng tan trong nước và tạo thành dung dịch ion giúp dễ dàng vận chuyển các ion cần thiết cho các quá trình sinh học sống cũng như quá trình điều chế hóa chất. Đặc biệt, muối thường được sử dụng để biến đổi và duy trì môi trường pH phù hợp cho các phản ứng hóa học và sinh học diễn ra.
Ngoài tính chất tan trong nước, muối còn có tính chất oxi-hoá khá quan trọng. Một số loại muối như muối bromua hay muối clo được sử dụng để diệt khuẩn, khử trùng trong nước và giữ vệ sinh môi trường sản xuất. Muối cũng có thể được sử dụng để điều chỉnh hiệu quả của các phản ứng hoá học, tạo ra màu sắc độc đáo cho các chất phẩm và hỗ trợ trong việc tạo ra các chất phụ gia.
Trên cơ sở những tính chất trên, muối đã trở thành một yếu tố không thể thiếu trong cuộc sống hàng ngày của chúng ta. Hiểu rõ tính chất hoá học của muối có thể giúp chúng ta tận dụng tối đa những ứng dụng của chúng và đảm bảo sự an toàn và hiệu quả trong việc sử dụng muối trong các lĩnh vực khác nhau.
Bài tập Hoá lớp 9:
1. Cho biết định nghĩa của muối là gì?
2. Để muối hoà tan nhanh hơn, người ta thêm chất gì vào nước?
3. Cho biết một số ứng dụng của muối trong đời sống hàng ngày.
4. Muối có khả năng giữ màu sắc của thực phẩm và chất phẩm. Điều này có ý nghĩa gì?
Trong đời sống, khi nói đến muối thì đó là một loại gia vị có vị mặn. Tuy nhiên, đối với hóa học, muối có nhiều loại khác nhau. Vậy tính chất hóa học của muối là gì? Cùng Chúng Tôi khám phá nhé!
Muối là gì?
Muối là gì?
Trong hóa học, muối là một khái niệm chung dùng để chỉ một hợp chất. Hợp chất của muối gồm nhiều nguyên tử kim loại liên kết với một hay nhiều gốc axit tạo thành.
Cùng Chúng Tôi tìm hiểu những thành phần và tính chất hoá học của muối kỹ hơn ngay sau đây nhé!

Thành phần hoá học của muối
Thành phần hoá học của muối có công thức hoá học gồm một hay nhiều nguyên tử kim loại (Na,Cu,Al,…) hoặc gốc amoni NH4+ kết hợp với một hay nhiều gốc axit (Cl-,SO42-,PO43-,…).
Tên muối = tên kim loại (thêm hóa trị nếu kim loại có nhiều hoá trị) + tên gốc axit.
Ví dụ:
- Na2SO4: natri sunfat.
- Fe(NO3)3: sắt (III) nitrat.
- KHCO3: kali hiđrocacbonat.
Chú ý:
- – Cl: clorua.
- =S: sunfua.
- = SO3: sunfit.
- = SO4: sunfat.
- =CO3: cacbonat.
- ≡ PO4: photphat.
Phân loại muối
Theo thành phần hoá học của muối có thể chia làm hai loại:
Muối trung hoà:
- Muối trung hoà là muối mà trong gốc axit không có nguyên tử hiđro H có thể thay thế bằng nguyên tử kim loại.
- Ví dụ: Na2SO4, Na2CO3, CaCO3.
Muối axit:
- Muối axit là muối mà trong đó gốc axit của phân tử còn nguyên tử hiđro H chưa được thay thế bằng kim loại.
- Ví dụ: NaHSO4, K2HPO4, Ba(HCO3)2,…
- Hoá trị của gốc axit bằng số nguyên tử hiđro H đã được thay thế bằng kim loại.
Chắc hẳn qua những câu hỏi trên đây bạn đã biết khái niệm và thành phần của muối hóa học. Tiếp tục cùng Chúng Tôi khám phá chi tiết tính chất hoá học của muối nhé!
Tính chất hóa học của muối
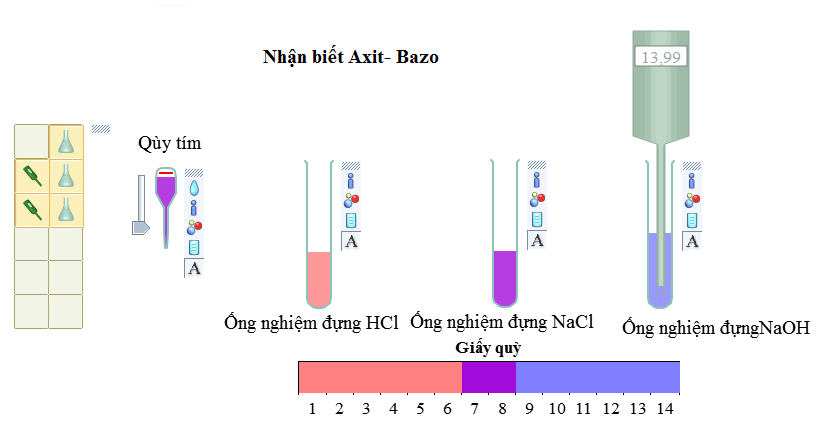
Muối làm đổi màu chất chỉ thị màu
Tính chất hoá học của muối đầu tiên của muối là làm thay đổi màu chất chỉ thị màu.
- Khi kim loại mạnh kết hợp với gốc axit yếu thì dung dịch muối đó sẽ làm đổi màu quỳ tím thành màu xanh. Ví dụ: Na2CO3, KBr, K2CO3,…
- Khi kim loại yếu kết hợp với gốc axit mạnh thì dung dịch muối đó sẽ làm đổi màu quỳ tím thành đỏ. Ví dụ: Ag2SO4,…
- Khi kim loại mạnh kết hợp với một gốc axit mạnh hoặc cả 2 có tính chất ngang nhau thì dung dịch muối đó sẽ không đổi màu quỳ tím. Ví dụ: KNO3, NaCl, CuSO3,…
Kết luận: muối có tính axit mạnh hơn làm quỳ tím hóa đỏ. Nếu tính bazơ mạnh hơn làm quỳ tím hóa xanh và quỳ tím không đổi màu khi muối đó trung tính.
Tác dụng với kim loại
Tính chất hoá học của muối tiếp theo là tác dụng với kim loại. Điều kiện: Kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối.
Muối tác dụng với kim loại → muối mới + kim loại mới. Như K > Na > Ca > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Hg > Ag > Pt > Au.
Ví dụ:
- Fe + CuSO4 → FeSO4 + Cu↓.
- Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓.

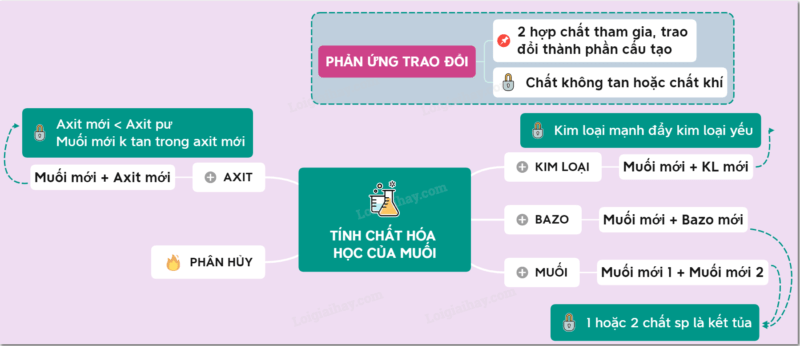
Phản ứng phân huỷ muối
Tính chất hoá học của muối không chỉ tác dụng với kim loại, axit. Mà bản thân muối cũng có phản ứng phân hủy riêng. Nhiều muối bị phân hủy ở nhiệt độ cao như: KClO3, KMnO4, CaCO3,…
Ví dụ:
- 2KClO3 →t0 2KCl + 3O2.
- CaCO3CaCO3 t0→ CaO + CO2.
Tác dụng với axit
Kế tiếp tính chất hoá học của muối là tác dụng với axit. Điều kiện: Axit mới yếu hơn axit phản ứng hoặc muối mới không tan trong axit mới. Tác dụng với axit → muối mới + axit mới.
Ví dụ:
- BaCl2 + H2SO4 → 2HCl + BaSO4↓.
- CaCO3 + 2HCl → CaCl2 + CO2CO2↑ + H2O.
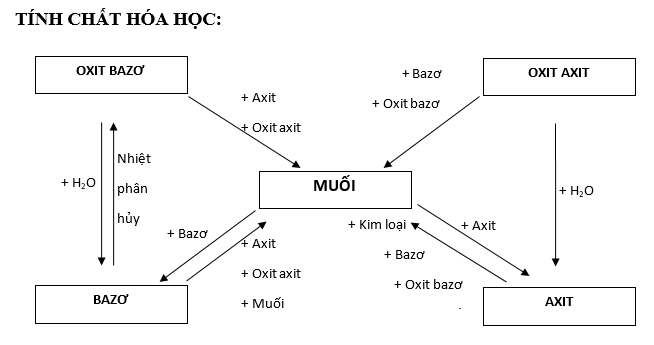
Tác dụng với dung dịch muối
Tính chất hoá học của muối đặc biệt nhất là muối có thể tác dụng với dung dịch muối tạo thành 2 muối mới.
Ví dụ:
- NaCl + AgNO3 → AgCl ↓+ NaNO3.
- Na2SO4 + BaCl2→ BaSO4↓ + 2NaCl.
Tác dụng với dung dịch bazơ
Tính chất hoá học của muối cuối cùng là tác dụng với dung dịch bazơ. Muối có thể tác dụng với dung dịch bazơ tạo thành muối mới và bazơ mới.
Ví dụ:
- Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓.
- NaOH + FeSO4 = Fe(OH)2 + Na2SO4.
- NaOH + FeS = Na2S + Fe(OH)2.
Bài viết liên quan:
- Tổng hợp 5 tính chất hóa học của bazơ bạn nên biết
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
- Tính chất hóa học của kim loại? 6 ứng dụng kim loại phổ biến nhất
Phản ứng trao đổi dung dịch muối
Phản ứng trao đổi là gì?
Phản ứng trao đổi là phản ứng hóa học. Trong đó hai hợp chất tham gia phản ứng trao đổi với nhau để tạo ra những hợp chất mới. Trong phản ứng trao đổi, số oxi hóa của các nguyên tố trong phản ứng không thay đổi.
Ví dụ:
- NH4NO3 + BaCl2 → NH4Cl + Ba(NO3)2.
- ZnSO4 + MgCl2 + Na3PO4 → ZnCl2 + Mg3PO42 + Na2SO4.
- Na2CO3+CaCl2 →CaCO3 +NaCl.
Điều kiện xảy ra phản ứng trao đổi
Điều kiện để phản ứng trao đổi xảy ra: nếu sản phẩm được tạo thành trong quá trình trao đổi là chất khí hay chất không tan.
Ví dụ:
- K2SO4 + NaOH: Phản ứng không xảy ra.
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
Lưu ý: phản ứng trung hòa cũng thuộc loại phản ứng trao đổi luôn xảy ra.
Ví dụ:
- H2SO4 + 2NaOH → Na2SO4 + 2H2O.
Một số bài tập về tính chất hoá học của muối lớp 9
Bài 1. Trang 33 Hóa 9 bài 9. Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:
- Chất khí.
- Chất kết tủa.
Viết các phương trình hóa học.
Hướng dẫn giải bài 1:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
Tạo ra chất khí
Ví dụ muối cacbonat (CaCO3, Na2CO3, NaHCO3) hoặc dung dịch muối sunfit (Na2SO3) tác dụng với axit (HCl, H2SO4 loãng):
- CaCO3 + H2SO4 → CaSO4 + CO2 ↑ + H2O.
- Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O.
- Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O.
Tạo chất kết tủa
Ví dụ dung dịch muối (BaCl2, Ba(CH3COO)2, Ba(NO3)2,…) tác dụng với dung dịch H2SO4 tạo ra kết tủa BaSO4.
- BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl.
- Ba(CH3COO)2 + H2SO4 → BaSO4 + 2CH3COOH.
Hoặc những dung dịch muối bari tác dụng với dung dịch muối cacbonat (Na2CO3, K2CO3) tạo ra BaCO3 kết tủa.
- Ba(NO3)2 + Na2CO3 → BaCO3 ↓ + 2NaNO3.
Bài 2. Trang 33 Hóa 9 bài 9. Có 3 lọ không nhãn, mỗi lọ đựng một dung dịch muối: CuSO4, AgNO3, NaCl. Hãy dùng những dung dịch có sẵn trong phòng thí nghiệm để nhận biết chất đựng trong mỗi lọ.
Viết các phương trình hóa học và cho biết tính chất hoá học của muối.
Hướng dẫn giải bài 2:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
Dùng dung dịch NaCl tự pha chế để nhận biết dung dịch AgNO3. Xuất hiện chất kết tủa trắng AgCl.
AgNO3 + NaCl → AgCl ↓ + NaNO3 .
Dùng dung dịch NaOH trong phòng thí nghiệm để nhận biết dung dịch CuSO4 màu xanh lam.
CuSO4 + NaOH → Cu(OH)2 + Na2SO4.
Dung dịch còn lại trong lọ không nhãn là dung dịch NaCl.
Bài 3. Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Vận dụng tính chất hoá học của muối cho biết muối thể tác dụng với những chất nào sau đây:
- Dung dịch NaOH.
- Dung dịch HCl.
- Dung dịch AgNO3.
Nếu có phản ứng, dựa vào tính chất hoá học của muối hãy viết các phương trình hóa học.
Hướng dẫn giải bài 3:
Dựa vào tính chất hoá học của muối, ta có những PTHH sau đây:
- Tác dụng với dung dịch NaOH là dung dịch các muối Mg(NO3)2 và CuCl2 vì sinh ra
- Mg(OH)2 kết tủa, Cu(OH)2 kết tủa.
- Mg(NO3)2 + 2NaOH → Mg(OH)2 ↓ + 2NaNO3.
- CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl.
- Không muối nào tác dụng với dung dịch HCl.
- Tác dụng với dung dịch AgNO3 là dung dịch muối CuCl2 tạo AgCl kết tủa trắng. PTHH: CuCl2 + 2AgNO3 → 2AgCl ↓ + Cu(NO3)2.

Hy vọng các bạn biết được công thức hóa học của muối cùng một số bài tập về tính chất hoá học của muối lớp 9. Đừng quen share và follow bài viết để Chúng Tôi có thêm động lực chia sẻ kiến thức nữa nhé.
Tính chất hoá học của muối là những đặc điểm và reakcji hóa học mà muối có thể thể hiện. Muối là một hợp chất hóa học được tạo thành từ phản ứng giữa axit và bazơ, trong đó axit cấp điện từ bazơ để tạo ra muối và nước. Muối có nhiều tính chất hoá học quan trọng và đa dạng.
Muối có khả năng tạo thành dung dịch điện li khi tan trong nước. Điện li trong dung dịch muối cho phép dòng điện chạy qua, làm tăng tính hòa tan và dẫn nhiệt của nước. Điều này làm cho muối được sử dụng rộng rãi trong việc làm mát các hệ thống công nghiệp và là thành phần quan trọng trong việc điều chỉnh cân bằng điện giữa các tế bào trong cơ thể.
Muối có khả năng tạo phản ứng trao đổi ion trong dung dịch, trong đó các ion của muối có thể trao đổi với các ion khác để tạo thành các hợp chất mới. Điều này dẫn đến khả năng của muối tham gia vào nhiều loại phản ứng hóa học, bao gồm các phản ứng khử-oxi, phản ứng trao đổi ion và phản ứng kết tủa.
Ngoài ra, muối có khả năng hấp thụ và giữ nước, được sử dụng rộng rãi trong quá trình muối hóa thực phẩm, nhằm kéo dài tuổi thọ và cải thiện vị ngon của thực phẩm. Muối cũng có khả năng ức chế sự phát triển của vi khuẩn và các loại vi sinh vật khác, làm cho muối trở thành một chất bảo quản tự nhiên.
Tóm lại, tính chất hoá học của muối bao gồm khả năng tạo dung dịch điện li, tham gia vào các phản ứng hóa học và có khả năng hấp thụ nước và ức chế sự phát triển của vi sinh vật. Điều này giúp muối trở thành một chất có sự ứng dụng rộng rãi trong công nghiệp và đời sống hàng ngày.
Cảm ơn bạn đã xem bài viết Tính chất hoá học của muối là gì? Bài tập Hoá lớp 9 tại Thcslytutrongst.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Tính chất vật lý của muối
2. Tính chất hóa học của muối
3. Đặc điểm hoá học của muối
4. Phản ứng hóa học của muối
5. Khả năng hoà tan của muối
6. Tính chất acid-base của muối
7. Tính chất oxi hóa của muối
8. Điểm nóng chảy của muối
9. Điểm sôi của muối
10. Tính chất độc hại của muối
11. Tính chất chống ăn mòn của muối
12. Tính chất chống dẫn điện của muối
13. Tính chất chống phản ứng hóa học của muối
14. Tính chất chống cháy của muối
15. Tính chất chống ố vàng của muối


