Bạn đang xem bài viết Tổng hợp 5 tính chất hóa học của bazơ – Hóa học 9 tại Thcslytutrongst.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Bazơ, còn được gọi là chất kiềm, là một trong những loại hợp chất hóa học quan trọng và được sử dụng rộng rãi trong cuộc sống hàng ngày. Với các tính chất đặc trưng riêng, bazơ có vai trò quan trọng trong các quá trình hóa học và có thể tạo ra những hiệu ứng đặc biệt. Trong bài viết này, chúng ta sẽ tập trung vào việc tổng hợp 5 tính chất hóa học của bazơ, nhằm giúp bạn hiểu rõ hơn về đặc điểm và ứng dụng của chúng trong lĩnh vực hóa học. Bài viết này dành cho bạn, học sinh lớp 9, nhằm mở rộng kiến thức và nắm vững những kiến thức căn bản về bazơ.
Bazơ là một loại hợp chất quan trọng trong hóa học. Người ta thường ứng dụng tính chất hóa học của bazơ trong đời sống. Vậy tính chất hóa học của bazơ là gì? Trong bài viết này Chúng Tôi sẽ trả lời cho bạn nhé!
Bazơ là gì?
Bazơ là gì?
Bazơ là một hợp chất hóa học. Trong đó, phân tử bao gồm một nguyên tử kim loại liên kết với một hay nhiều nhóm OH (Hydroxit). Bạn cũng có thể hiểu bazơ là chất hòa tan trong nước sẽ tạo thành dung dịch có độ pH lớn hơn 7.
Bazơ có công thức chung là B(OH)n. Trong đó:
- B là một kim loại.
- n là hóa trị kim loại (hóa trị của kim loại bằng số nhóm Hydroxit).
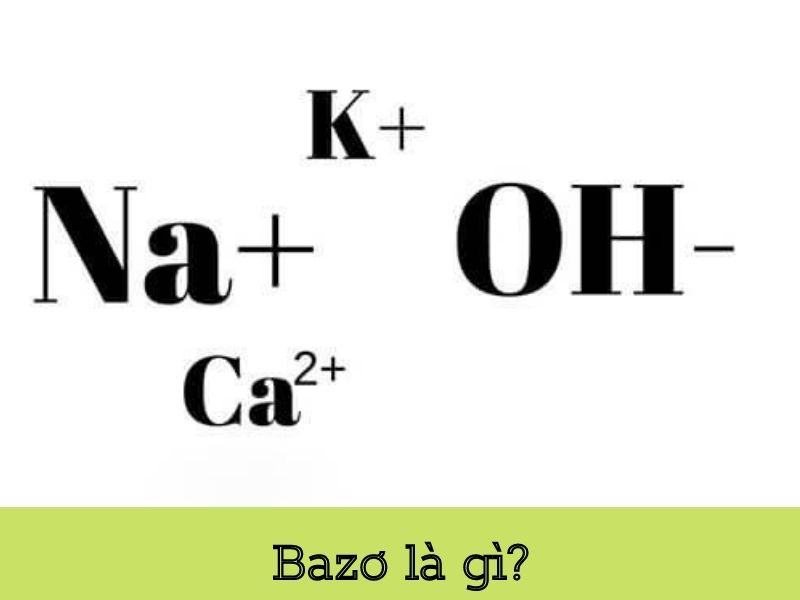
Phân loại bazơ
Ta có thể phân loại bazơ theo những yếu tố sau:
Dựa vào tính chất hóa học
Dựa vào tính chất hóa học của bazơ ta có thể chia bazơ thành 2 loại:
- Bazơ mạnh như NaOH, KOH,…
- Bazơ yếu như Fe(OH), Al(OH)3, Cu(OH)2,…
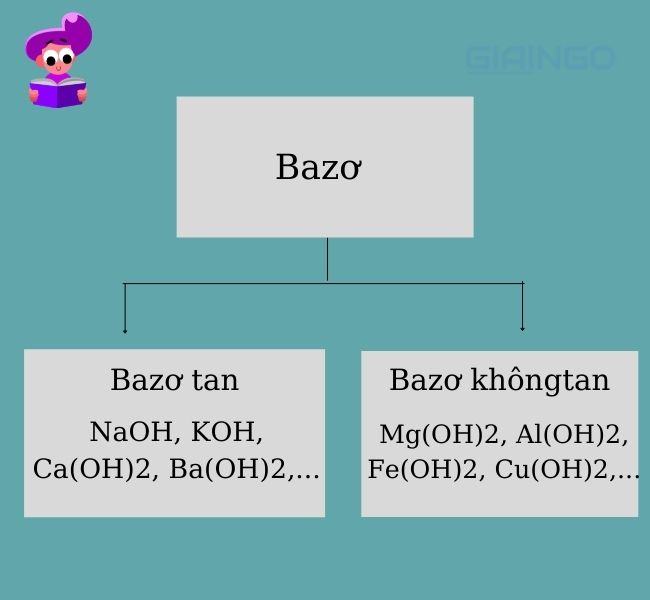
Dựa vào tính tan của bazơ trong nước
Dựa vào tính tan trong nước, người ta phân loại bazơ như sau:
- Bazơ tan (hay gọi là bazơ kiềm): Gồm những bazơ có kim loại liên kết đứng trước Mg trong dãy hoạt động hóa học của kim loại. Ví dụ: KOH, NaOH, Ba(OH)2, Ca(OH)2,…
- Bazơ không tan: Gồm những bazơ có kim loại liên kết đứng sau Mg trong dãy hoạt động hóa học của kim loại. Ví dụ: Zn(OH)2, Fe(OH)2, Al(OH)3,…
Ngoài ra, người ta còn phân loại bazơ thành các nhóm như bazơ kim loại, amoniac (NH3) và các amin mang tính bazơ, hợp chất có tính bazơ chứa vòng thơm và các bazơ vòng thơm khác (hợp chất chứa vòng vòng thơm gọi là aren gồm benzen và đồng đẳng).
Cách đọc tên bazơ như thế nào?
Cách đọc tên bazơ rất đơn giản. Bazơ được gọi tên theo trình tự như sau:
Tên bazơ = Tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + Hydroxit.
Ví dụ:
- NaOH: Natri hydroxit.
- Cu(OH)2: Đồng (II) hydroxit.
- Fe(OH)2: Sắt (II) hydroxit.
- Mg(OH)2: Magie hydroxit.
Tính chất hóa học của bazơ
Mời bạn đọc cùng Giaingo tìm hiểu 5 tính chất hóa học của bazơ ngay sau đây nhé!
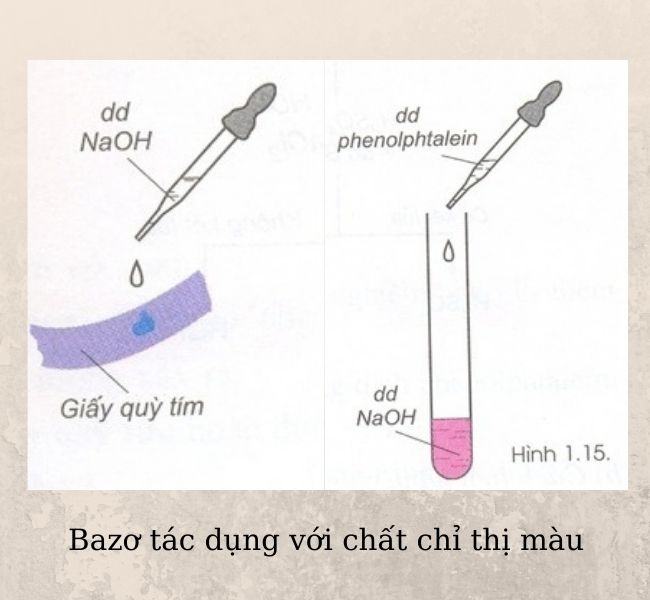
Tác dụng với chất chỉ thị màu
Tính chất hóa học của bazơ đầu tiên đó là tác dụng với chất chỉ thị màu. Bazơ sẽ làm đổi màu chất chỉ thị màu. Cụ thể sẽ có phản ứng như sau:
- Bazơ làm đổi màu quỳ tím thành màu xanh.
- Bazơ làm dung dịch Phenolphthalein không màu đổi sang màu hồng.
- Bazơ làm đổi màu Methyl cam sang vàng.
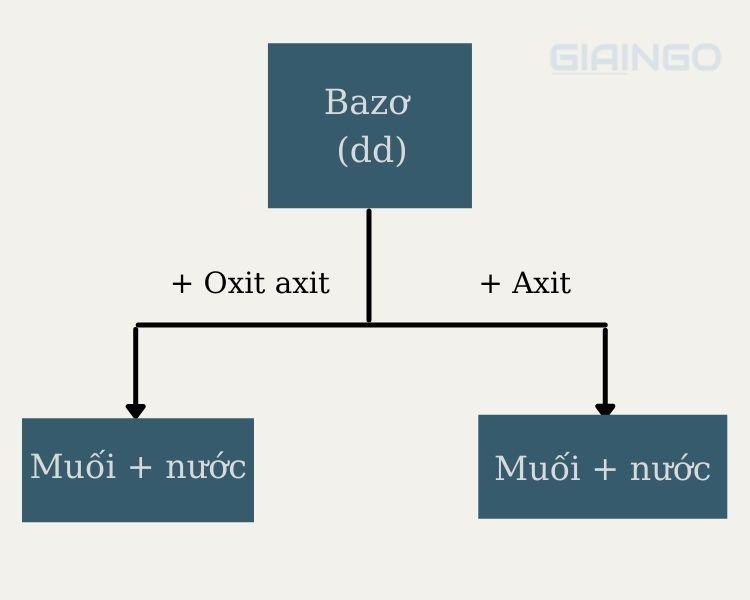
Dung dịch bazơ tác dụng oxit axit
Khi dung dịch bazơ tác dụng với oxit axit sẽ tạo thành muối và nước. Phương trình phản ứng như sau:
2NaOH + SO2 → Na2SO3 + H2O.
3Ca(OH)2 + P2O5 → Ca3(PO4)2↓ + 3H2O.
Ba(OH)2 + CO2 → BaCO3 + H2O.
Bazơ (tan và không tan) tác dụng với axit
Bazơ (bazơ kiềm) tác dụng với dung dịch axit tạo thành muối và nước. Phản ứng này còn gọi là phản ứng trung hòa. Phương trình phản ứng như sau:
KOH + HCl → KCl + H2O.
NaOH + HCl → NaCl + H2O.
Cu(OH)2 + 2HNO3 → Cu(NO3)2 + H2O.
Dung dịch bazơ tác dụng với nhiều dung dịch muối
Dung dịch bazơ tác dụng với một số dung dịch muối để tạo thành muối mới và bazơ mới. Điều kiện để phản ứng xảy ra đó là muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Phương trình phản ứng như sau:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓.
KOH + CuSO4 → K2SO4 + Cu(OH)2↓.
Bazơ không tan bị nhiệt phân
Bazơ không tan sẽ bị nhiệt phân hủy thành oxit và nước theo phương trình phản ứng sau đây:
Cu(OH)2 → CuO + H2O.
2Fe(OH)3 →Fe2O3 + 3H2O.
Trên đây là tính chất hóa học của bazơ, hẳn bạn đã phần nào nắm được kiến thức cơ bản của bazơ rồi phải không nào? Tiếp tục theo dõi Chúng Tôi để tìm hiểu tính chất vật lý của bazơ nhé!
Bài viết liên quan:
- Tính chất hóa học của hidro là gì? Cách điều chế hidro
- Tính chất hóa học của axit? 5 ứng dụng axit phổ biến nhất
- Tính chất hóa học của oxit? Khái quát về 4 loại oxit đặc trưng
Tính chất vật lý của bazơ
Bên cạnh tính chất hóa học của bazơ, tính chất vật lý cũng không kém phần quan trọng. Mời bạn cùng Chúng Tôi đi tìm hiểu tính chất vật lý của bazơ để hiểu hơn nhé!
- Bazơ tồn tại ở dạng rắn, bột, đôi khi ở trạng thái dung dịch.
- Bazơ tan trong nước thường không màu, bazơ không tan trong nước (kết tủa) thường có màu.
- Bazơ có nồng độ cao; bazơ mạnh có tính ăn mòn chất hữu cơ và tác dụng mạnh với các hợp chất axit.
- Bazơ sẽ gây ra cảm giác nhờn.
- Bazơ có mùi và có vị đắng.

Một số loại bazơ thường gặp
Tìm hiểu tính chất hóa học của bazơ, bạn không nên bỏ qua ứng dụng của nó trong đời sống. Các bazơ thường gặp và phổ biến phải kể đến đó là NaOH, Ca(OH)2, Cu(OH)2, KOH, Ba(OH)2,….
Trong đó, NaOH và Ca(OH)2 là hai loại bazơ đóng vai trò cực kỳ quan trọng trong đời sống và sản xuất công nghiệp.
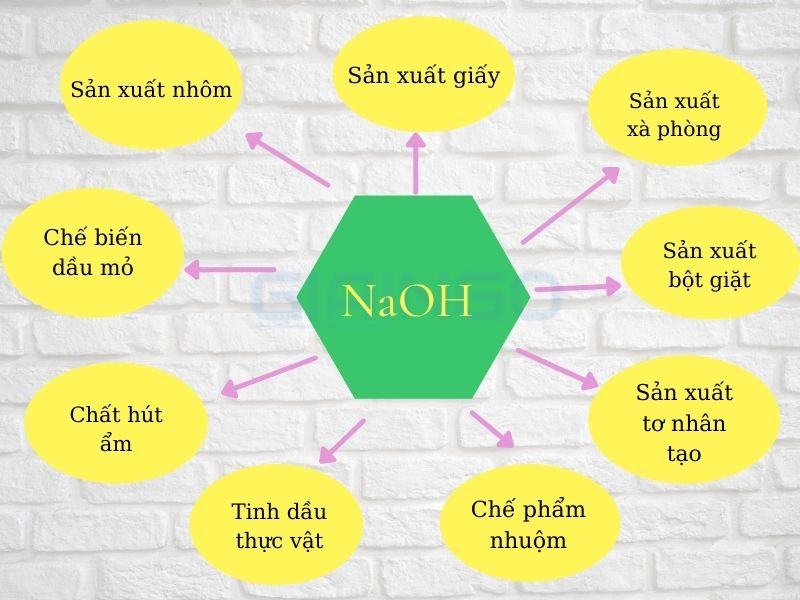
Natri hydroxit NaOH
Natri hydroxit được ứng dụng phổ biến trong công nghiệp sản xuất xà phòng, sản xuất giấy, tơ nhân tạo, tinh dầu thực vật, các sản phẩm chưng cất dầu mỏ, chế phẩm nhuộm, hóa chất xử lý nước,…
Ngoài ra, Natri hydroxit còn dùng làm thuốc thử thông dụng trong phòng thí nghiệm.
Canxi hydroxit Ca(OH)2
Canxi hydroxit được ứng dụng phổ biến trong xử lý nước và cải tạo độ chua của đất. Đây còn là thành phần chính của vôi vữa trong xây dựng.
Trong công nghiệp, Canxi hydroxit được dùng để sản xuất các phụ gia cho dầu thô, xử lý nước để sản xuất các loại đồ uống như rượu hay đồ uống không cồn,…
Bài tập về tính chất hóa học của bazơ
Một số bài tập về tính chất hóa học của bazơ cho bạn đọc tham khảo nhé!
Bài 1: Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của 3 chất kiềm để minh họa. Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học những bazơ để minh họa (Trang 25 SGK Hóa Học 9).
Hướng dẫn giải:
- Tất cả các chất kiềm đều là bazơ. Vì kiềm là một loại bazơ tan được trong nước.
Ví dụ: NaOH, KOH, Ca(OH)2.
- Không phải tất cả bazơ đều là chất kiềm. Vì không phải mọi bazơ đều tan trong nước.
Ví dụ: Cu(OH)2, Al(OH)3, Fe(OH)3.
Bài 2: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu: NaCl, Ba(OH)2, NaOH và Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết phương trình hóa học (Trang 25 SGK Hóa Học 9).
Hướng dẫn giải:
Bước 1: Trích mẫu thử vào ống nghiệm và đánh số thứ tự tương ứng.
Bước 2: Cho quỳ tím vào từng mẫu thử và quan sát, ta thấy:
- Những dung dịch làm quỳ tím chuyển sang màu xanh: Ba(OH)2 và NaOH (Nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu: NaCl và Na2SO4 (Nhóm 2).
Bước 3: Tiếp tục lấy một chất ở nhóm (1) cho lần lượt vào mỗi chất ở nhóm (2).
- Nếu có xuất hiện kết tủa ⇒ chất lấy ở nhóm (1) là Ba(OH)2, chất ở nhóm (2) là Na2SO4.
- Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng hóa học: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH.
Bài 3: Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào:
a) Tác dụng được với dung dịch HCl?
b) Bị nhiệt phân hủy?
c) Đổi màu quỳ tím thành xanh?
Viết phương trình hóa học.
Hướng dẫn giải:
a) Tất cả các bazơ đã cho đều phản ứng với dung dịch HCl.
Cu(OH)2 + 2HCl → CuCl2 + 2H2O.
NaOH + HCl → NaCl + H2O.
Ba(OH)2 + 2HCl → BaCl2 + H2O.
b) Bị phân hủy ở nhiệt độ cao là các bazơ không tan : Cu(OH)2
Cu(OH)2 CuO + H2O.
c) Các bazơ đổi màu quỳ tím thành xanh gồm NaOH, Ba(OH)2.

Hy vọng với bài viết này bạn đọc đã nắm được kiến thức về tính chất hóa học của bazơ. Đừng quên cập nhật tin tức tại Chúng Tôi hàng ngày nhé! Nếu bạn thắc mắc bất cứ vấn đề gì đừng ngần ngại để lại comment Chúng Tôi sẽ giải đáp giúp bạn.
Trong bài viết này, chúng ta đã tìm hiểu về 5 tính chất hóa học cơ bản của bazơ. Bazơ là một loại chất hóa học có tính chất đặc trưng và có vai trò quan trọng trong nhiều quá trình hóa học và các ứng dụng khác. Dưới đây là tổng hợp về 5 tính chất hóa học của bazơ:
1. Tính bazơ: Tính chất cơ bản của bazơ là có khả năng nhận và nhận các electron. Bazơ có khả năng tạo thành các cặp electron mới với các chất khác để tạo thành các liên kết hóa học mới.
2. Tính gây hỏa cháy: Đa số bazơ có khả năng gây hỏa cháy hoặc cháy mạnh khi tiếp xúc với các chất cháy. Điều này liên quan đến khả năng chuyển giao electron từ bazơ đến các chất khác, gây ra các phản ứng oxi-hoá.
3. Tính phản ứng với axit: Bazơ có khả năng phản ứng với axit và tạo thành muối và nước. Quá trình này được gọi là phản ứng trung hòa và tạo ra các sản phẩm ổn định hơn.
4. Tính trung hòa: Bazơ có khả năng trung hòa các axit. Quá trình trung hòa giúp duy trì cân bằng pH trong các hệ thống hóa học và sinh học.
5. Tính tương tác với kim loại: Bazơ có khả năng tạo thành các hợp chất với kim loại. Điều này cho phép bazơ được sử dụng trong nhiều ứng dụng công nghiệp, như là chất xúc tác trong quá trình tổng hợp hữu cơ và sản xuất thuốc nhuộm.
Tóm lại, các tính chất hóa học của bazơ có vai trò quan trọng trong nhiều quá trình và ứng dụng khác nhau. Hiểu rõ những tính chất này sẽ giúp chúng ta áp dụng và sử dụng bazơ một cách hiệu quả trong các lĩnh vực công nghiệp, sinh học và hóa học.
Cảm ơn bạn đã xem bài viết Tổng hợp 5 tính chất hóa học của bazơ – Hóa học 9 tại Thcslytutrongst.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Bazơ
2. Tính chất hóa học
3. Tính bazơ
4. Độ ion hóa bazơ
5. Phản ứng bazơ-viên
6. Sự trung hòa bazơ axit
7. Kiềm
8. Phản ứng giữa bazơ và muối
9. Tính chất bazơ trong hóa học
10. Điểm chính có về tính chất hóa học của bazơ
11. Phản ứng trao đổi nhiệt
12. Tính chất cơ bản của các bazơ
13. Sự tác dụng với axit
14. Hiện tượng phân giải bazơ axit
15. Tác dụng và ứng dụng của bazơ trong công nghiệp và sinh hoạt.


