Bạn đang xem bài viết Các công thức Hóa học lớp 9? Một số bài tập điển hình tại Thcslytutrongst.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Hóa học là một môn học quan trọng trong chương trình giáo dục phổ thông, đặc biệt là trong chương trình lớp 9. Trên cơ sở kiến thức đã được công bố trong các năm học trước đó, học sinh tiếp tục khám phá các công thức hóa học cơ bản và áp dụng chúng vào các bài tập điển hình.
Công thức hóa học là một cách biểu diễn các chất hóa học thông qua các ký hiệu và số liệu. Việc nắm vững và sử dụng các công thức thành thạo là một yếu tố quan trọng trong việc hiểu và áp dụng trong hóa học. Trong chương trình lớp 9, học sinh sẽ được tiếp cận với nhiều loại công thức khác nhau, từ công thức phân tử, công thức cấu tạo đến công thức phản ứng.
Một số bài tập điển hình trong môn hóa học lớp 9 có thể bao gồm viết và cân đối phản ứng hóa học, tính toán hệ số phản ứng, xác định phân tử chất khí qua công thức hóa học và tính số mol của chất.
Ví dụ, một bài tập điển hình có thể yêu cầu học sinh viết và cân đối phản ứng hóa học, ví dụ như phản ứng giữa sắt và oxi tạo thành sắt III oxit. Học sinh cần biết cách viết công thức hóa học của sắt, oxi và sắt III oxit, và sau đó cân đối các hệ số để đảm bảo nguyên tắc bảo toàn khối lượng.
Bài tập khác có thể yêu cầu học sinh tính toán hệ số phản ứng dựa trên lượng chất ban đầu và lượng chất cần tạo ra. Đây là một bài tập quan trọng giúp học sinh hiểu rõ hơn về quy luật bảo toàn khối lượng và quy luật Avogadro.
Trên thực tế, công thức hóa học là một phần không thể thiếu trong quá trình nghiên cứu và ứng dụng trong các lĩnh vực khác nhau như y học, công nghệ, môi trường và nông nghiệp. Việc nắm vững các công thức hóa học từ lớp 9 là nền tảng quan trọng để học sinh có thể tiếp tục học tập và rèn luyện kiến thức trong hóa học các cấp học cao hơn.
Để có thể làm tốt được tất cả các dạng bài tập về Hóa học lớp 9 thì các bạn cần phải nắm rõ toàn bộ các công thức liên quan đến phần kiến thức các bạn đã học. Vậy các công thức Hóa học lớp 9 bao gồm những gì? Cùng Chúng Tôi tìm hiểu ngay sau đây để học tốt hơn bạn nhé!
Tóm tắt các công thức Hóa học lớp 9
Chương 1: Các loại hợp chất vô cơ
Bài toán CO2, SO2 dẫn vào dung dịch kiềm là NaOH, KOH
Khi ta cho CO2 (hoặc SO2) tác dụng với dung dịch kiềm là NaOH thì sẽ xảy ra những khả năng tạo muối như sau:
CO2 + 2NaOH → Na2CO3 + H2O (1)
CO2 + NaOH → NaHCO3 (2)
Đặt T = nNaOH / nCO2
Nếu T = 2: chỉ tạo ra muối Na2CO3 (muối trung hòa)
Nếu T ≤ 1: chỉ tạo ra muối NaHCO3 (muối axit)
Nếu 1 < T < 2: tạo ra cả muối NaHCO3 và Na2CO3 (muối axit và muối trung hòa)
Bài toán CO2, SO2 dẫn vào dung dịch kiềm Ca(OH)2, Ba(OH)2
Ta có phương trình phản ứng hóa học sau:
Ca(OH)2 + CO2 → CaCO3↓ + H2O (1)
Ca(OH)2 + 2CO2 → Ca(HCO3)2 (2)
Sau đó:
Đặt T = nCO2 / nCa(OH)2
Nếu T ≤ 1: chỉ tạo ra muối CaCO3
Nếu T = 2: chỉ tạo ra muối Ca(HCO3)2
Nếu 1 < T < 2: tạo ra cả muối CaCO3 và Ca(HCO3)2
Ví dụ: Dẫn 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng là gì?
Bài giải:
Ta có: nCO2 = 2,24 / 22,4 = 0,1 mol
T = nNaOH / nCO2 = 0,2 / 0,1 = 2
Vậy khi T = 2 thì sản phẩm thu được là Na2CO3.

Chương 2: Kim loại
Phương pháp tăng giảm khối lượng
A + B2(SO4)n → A2(SO4)m + B
Trong đó:
- A,B là kim loại
- B2(SO4)n, A2(SO4)m là muối
Ta có 2 trường hợp sẽ xảy ra:
- Trường hợp 1: mA (tan ra) < mB (bám vào)
m B (bám vào) – m A (tan ra) = m kim loại tăng
- Trường hợp 2: mA (tan ra) > mB (bám vào)
m A (tan ra) – m B (bám vào) = m kim loại giảm
Bảo toàn khối lượng
Tổng khối lượng các chất tham gia = Tổng khối lượng chất tạo thành.
Khối lượng thanh kim loại + khối lượng dung dịch = Khối lượng thanh kim loại mới + khối lượng dung dịch mới.
Phản ứng nhiệt nhôm:
nH2 = nFe + (3/2).nAl
nH2 = nFe + (3/2).nAl

Chương 3: Phi kim
Số hiệu nguyên tử
Một vài kiến thức liên quan đến số hiệu nguyên tử mà bạn cần nhớ như sau:
- STT ô nguyên tố = số hiệu nguyên tử = số proton = số electron.
- STT chu kì = số lớp electron.
- STT của các nhóm A = số electron ở lớp ngoài cùng của nguyên tử trong nhóm đó.
Các phản ứng của C, CO, H2
Trong các phản ứng của C, CO, H2 thì số mol của CO= nCO2, nC= nCO2 và nH2= nH2O.
Ta có các công thức cần nhớ sau:
- m bình tăng = m hấp thụ
- m dung dịch tăng = m hấp thụ – m kết tủa
- m dung dịch giảm = m kết tủa – m hấp thụ

Chương 4: Hidrocacbon
Công thức tính độ bất bão hòa
Xét hợp chất: CxHyOzNtXv (với X là các nguyên tố nhóm halogen)
Độ bất bão hòa: k = ( 2 + 2x – (y+v) +t ) /2
Công thức tính số C, số H trong hiđrocacbon (CxHy)
Số Cacbon = nCO2 / nCxHy
Số Hydro = 2nH2O / nCxHy
Công thức tính phân tử khối của hợp chất hữu cơ
Ví dụ hợp chất hữu cơ có dạng là CxHyOz thì phân tử khối của hợp chất hữu cơ có thể được tính theo những cách sau:
- Dựa vào khối lượng mol hợp chất hữu cơ: M = 12x + y + 16z (g/mol)
- Dựa vào công thức liên hệ giữa khối lượng và số mol: M = m/n
- Dựa vào tỉ khối: dA/B = MA/MB; dA/kk = MA/Mkk =MA/29
Sau đó chúng ta dựa vào phần trăm khối lượng của các nguyên tố: %mC/12 = %mH/1 = %mO/16 để lập công thức phân tử.

Tìm công thức phân tử bằng phản ứng cháy của hợp chất hữu cơ
Để tìm được công thức phân tử bằng phản ứng cháy của hợp chất hữu cơ thì ta làm theo các bước sau:
- Bước 1: Lập công thức tổng quát của hợp chất hữu cơ: CxHyOz.
- Bước 2: Chuyển đổi các đại lượng đầu bài cho thành số mol.
- Bước 3: Viết phương trình tổng quát của phản ứng cháy:
CxHyOz + (x +y/4 – z/2)O2 -> xCO2 + y/2 H2O
- Bước 4: Thiết lập tỉ lệ số mol các nguyên tố trong công thức
Tìm khối lượng mỗi nguyên tố như sau: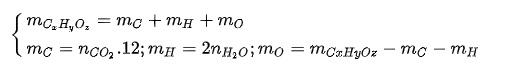
TH1: mCxHyOz = mC + mH => mO = 0, trong công thức phân tử chỉ có C và H (hidrocabon)
TH2: mO > 0, trong công thức phân tử có cả C, H, O
Tìm số mol nguyên tử của mỗi nguyên tố, thiết lập tỉ lệ số mol
![]()
- Bước 5: Biện luận công thức phân tử của hợp chất hữu cơ: M = (CxHyOz)n => n, M
Chương 5: Dẫn xuất của hidrocacbon – Polime
Công thức tính độ rượu
Độ rượu là số mol etylic có trong 100 ml hỗn hợp rượu với nước.
Công thức tính độ rượu như sau: (Vr / (Vr + VH2O)) / Vr
Trong đó:
- Vr: thể tích rượu nguyên chất.
- VH2O: thể tích nước có trong dung dịch

Xem thêm:
- N là gì trong Hóa học? Các ký hiệu trong công thức Hóa học
- C là gì trong Hóa học? Tổng hợp các công thức liên quan
- M là gì trong Hóa học? Một số công thức liên quan đến m và M
Một số bài tập điển hình
Để ghi nhớ lâu hơn các công thức Hóa học lớp 9 thì hãy cùng Chúng Tôi làm một vài bài tập sau đây nhé!
Bài tập 1:
Biết rằng 4,48 lít khí CO2 (ở đktc) tác dụng vừa đủ vơi 400ml NaOH tạo thành muối trung hòa.
a) Tính khối lượng muối thu được
b) Tính nồng độ mol của dung dịch NaOH đã dùng
Bài giải:
Sản phẩm tạo thành muối trung hòa là Na2CO3
Ta có phương trình hóa học của phản ứng như sau:
CO2 + 2NaOH → Na2CO3 + H2O
0,2→ 0,4 → 0,2
Số mol CO2: nCO2 = 0,2 mol
a) Khối lượng Na2CO3 tạo thành: mNa2CO3 = 0,2.106 = 21,2 gam
b) Nồng độ mol dung dịch NaOH đã dùng: CMNaOH = 0,4/0,4 = 1 M
Bài tập 2:
Trộn một dung dịch có hòa tan 0,2 mol CuCl2 với một dung dịch có hòa tan 20g NaOH. Lọc hỗn hợp các chất sau phản ứng, được kết tủa và nước lọc. Nung kết tủa đến khi khối lượng không đổi.
a) Viết các phương trình hóa học.
b) Tính khối lượng chất rắn thu được sau khi nung.
c) Tính khối lượng các chất có trong nước lọc.
Bài giải:
Ta có: nNAOH = 20/40 = 0.5 mol
a) Phương trình hóa học của phản ứng:
2NaOH + CuCl2 → Cu(OH)2 ↓ + 2NaCl (1)
Cu(OH)2 → CuO + H2O (2)
b) Khối lượng chất rắn thu được sau khi nung:
Theo phương trình (1):
nNaOH = 2nCuCl2 = 0,4 mol
nNaOH dư = 0,5 – 0,4 = 0,1 mol
Tính khối lượng chất rắn CuO, theo (1) và (2) ta có:
nCuO = nCu(OH)2 = nCuCl2 = 0,2 mol
mCuO = 0,2 x 80 = 16g.
c) Khối lượng các chất trong nước lọc:
Khối lượng NaOH dư: mNaOH = 0,1 x 40 = 4g
Khối lượng NaCl trong nước lọc:
nNaCl = nNaOH = 0,4 mol
mNaCl = 0,4 x 58,5 = 23,4g.
Bài tập 3:
Cho 9,2g một kim loại A phản ứng với khí clo dư tạo thành 23,4g muối. Hãy xác định kim loại A, biết rằng A có hóa trị I.
Bài giải:
Gọi nguyên tử khối của kim loại A là A.
Phương trình hóa học của phản ứng:
2A + Cl2 → 2ACl
mA = 9,2g, mACl = 23,4g.
Có nA = nACl
nA = 9,2 / A
nCl = 23,4 / (A + 35,5)
⇒ 9,2 x (A + 35,5) = A x 23,4.
⇒ A = 23. Vậy kim loại A là Na.
Bài tập 4:
Cho 69,6g MnO2 tác dụng với dung dịch HCl đặc dư thu được một lượng khí X. Dẫn khí X vào 500ml dung dịch NaOH 4M thu được dung dịch A. Tính nồng độ mol của các chất trong dung dịch A. Giả thiết rằng thể tích dung dịch sau phản ứng thay đổi không đáng kể.
Bài giải:
Ta có nMnO2 = 69,6 / 87 = 0,8 mol
VNaOH = 500ml = 0,5 lít ⇒ nNaOH = CM. V= 0,5 x 4 = 2 mol
Phương trình phản ứng:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
Theo pt: nCl2 = nMnO2 = 0,8 mol.
Cl2 + 2NaOH → NaCl + NaClO + H2O.
Ta có tỉ lệ: 0,8/1 < 2/2 → NaOH dư nên tính nNaCl và nNaClO theo nCl2
Theo pt: nNaCl = nNaClO = nCl2 = 0,8 mol.
CM(NaCl)= CM(NaClO) = 0,8/0,5 = 1,6 mol/l.
Theo pt: nNaOH pư = 2. nCl2 = 2. 0,8 = 1,6mol.
CM(NaOH) dư = (2 – 1,6) / 0,5 = 0,8 mol/l.
Bài tập 5:
Đốt cháy 3 gam chất hữu cơ A, thu được 8,8g khí CO2 và 5,4g H2O
a) Trong chất hữu cơ A có những nguyên tố nào?
b) Biết phân tử khối của A nhỏ hơn 40. Tìm công thức phân tử của A.
c) Chất A có làm mất màu dung dịch brom không?
d) Viết phương trình hóa học của A với clo khi có ánh sáng
Bài giải:
nCO2 = 8,8 / 44 = 0,2 mol.
⇒ Bảo toàn nguyên tố C: nC = nCO2 = 0,2 mol ⇒ mC = 0,2 × 12 = 2,4g.
nH2O = 5,4 / 18 = 0,3 mol.
Suy ra bảo toàn nguyên tố H: nH = 2nH2O = 0,6 mol ⇒ mH = 0,6 x 1 = 0,6g.
mC,H = 2,4 + 0,6 = 3g = mA có hai nguyên tố C và H. Vậy A là Hiđrocacbon
b) Đặt công thức phân tử của A là CxHy
x : y = mC/12 : mH /1 = 2,4/12 : 0,6/1 = 1:3
Vậy công thức phân tử của A có dạng (CH3)n vì MA < 40
→ (CH3)n < 40 ⇒ 15n < 40
• Nếu n = 1 ⇒ không hợp lý.
• Nếu n = 2 ⇒ Công thức phân tử của A là C2H6 (nhận)
c) A không làm mất màu dung dịch Br2.
d) C2H6 + Cl2 -> C2H5Cl + HCl
Bài tập 6:
Khi lên men dung dịch loãng của rượu etylic, người ta được giấm ăn.
a) Từ 10 lít rượu 8o có thể điều chế được bao nhiêu gam axit axetic? Biết hiệu xuất quá trình lên men là 92% và rượu etylic có D = 0,8 g/cm3.
b) Nếu pha khối lượng axit axetic trên thành dung dịch giấm 4% thì khối lượng dung dịch giấm thu được là bao nhiêu?
Bài giải:
a) Trong 10 lít rượu 80 thì có 10,8/100 = 0,8 lít rượu etylic
⇒ m rượu = V.D = 0,8.0,8.1000 = 640 (g)
Phương trình phản ứng lên men rượu:
C2H5OH + O2 → CH3COOH + H2O
nC2H5OH = 640/46 mol.
Theo PT: nCH3COOH = nC2H5OH = 640/46 mol
Khối lượng của axit: (640×60)/46 = 834,8 (g)
Vì hiệu suất quá trình lên men là 92% nên lượng axit có trong thực tế thu được:
maxit = 834,8. 92% = 768g
b) Khối lượng giấm thu được: m = (768 x 100) / 4 = 19200 g
Cách học nhanh các công thức Hóa học lớp 9
Nhìn chung các công thức Hóa học lớp 9 vẫn còn đang ở mức đơn giản. Vì vậy để học nhanh các công thức Hóa học lớp 9 thì bạn cần nắm vững các công thức Hóa học lớp 9 quan trọng.
Các bạn cũng có thể học các công thức Hóa học lớp 9 bằng việc tìm hiểu các bài hát hay các câu thơ liên quan đến các kiến thức đã học. Ví dụ như bài ca hóa trị, kí hiệu nguyên tố hóa học, thứ tự hoạt động của kim loại từ mạnh đến yếu,…
Ngoài ra, các để học nhanh các công thức Hóa học lớp 9 một cách hiệu quả nhất chính là hãy làm thật nhiều bài tập theo từng chương khác nhau. Điều này sẽ giúp bạn nhớ lâu các công thức Hóa học lớp 9 đấy nhé!

Trên đây là toàn bộ thông tin liên quan đến các công thức Hóa học lớp 9 và một số bài tập điển hình. Hy vọng bài viết này hữu dụng dành cho bạn. Hãy theo dõi Chúng Tôi mỗi ngày để biết thêm nhiều thông tin cũng như những kiến thức có ích nhé!
Trong bài viết này, chúng ta đã tìm hiểu về các công thức hóa học cơ bản của lớp 9 và đi qua một số bài tập điển hình. Chúng ta đã bắt đầu bằng việc giải thích về cách viết công thức hóa học và cách đọc và hiểu các công thức này.
Tiếp theo, chúng ta đã thảo luận về những nguyên tố hóa học quan trọng như Hydro, Oxi, Nitơ và cacbon, và tìm hiểu về cách xác định số nguyên tử trong công thức hóa học. Chúng ta đã thấy rằng việc hiểu công thức hóa học là cực kỳ quan trọng để có thể nắm bắt và sử dụng hiệu quả kiến thức về hóa học.
Sau đó, chúng ta đã thực hành qua một số bài tập điển hình. Chúng ta đã hoàn thành việc viết các công thức hóa học cho các hợp chất chưa biết và xác định số nguyên tử trong các công thức hóa học đã cho. Bài tập đã giúp chúng ta rèn kỹ năng phân tích và áp dụng các nguyên tắc hóa học đã học.
Từ bài viết này, chúng ta đã nhận thấy tầm quan trọng của việc nắm vững các công thức hóa học và khả năng áp dụng chúng trong thực tế. Các công thức hóa học không chỉ cung cấp cho chúng ta hiểu biết về các nguyên tố và hợp chất, mà còn giúp chúng ta hiểu về các quy tắc và quy luật hóa học. Việc nắm vững công thức hóa học sẽ giúp chúng ta đạt được sự thành công trong các bài tập và bài kiểm tra, và tạo ra nền tảng vững chắc cho việc nghiên cứu hóa học ở cấp độ cao.
Tóm lại, việc học các công thức hóa học lớp 9 không chỉ là việc nhớ thuộc và áp dụng, mà đó còn là việc hiểu và nắm vững công cụ quan trọng này. Qua việc học cách viết và đọc các công thức hóa học, chúng ta đang bước vào cánh cửa của hóa học hiện đại và mở ra cơ hội mới trong tương lai.
Cảm ơn bạn đã xem bài viết Các công thức Hóa học lớp 9? Một số bài tập điển hình tại Thcslytutrongst.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.
Từ Khoá Liên Quan:
1. Phản ứng hóa học lớp 9
2. Công thức hóa học lớp 9
3. Phân loại phản ứng hóa học lớp 9
4. Điều chế hợp chất hóa học lớp 9
5. Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học lớp 9
6. Cấu tạo hạt nhân và nguyên tử lớp 9
7. Tính chất và ứng dụng của oxi, hiđro, và nitơ lớp 9
8. Các phản ứng oxi-hiđro trong hóa học lớp 9
9. Các phản ứng trao đổi chất trong hóa học lớp 9
10. Các phản ứng trao đổi điện tích trong hóa học lớp 9
11. Bài tập về tính chất của chất trong hóa học lớp 9
12. Bài tập về cấu tạo hạt nhân và nguyên tử lớp 9
13. Bài tập về phân loại phản ứng hóa học lớp 9
14. Bài tập về điều chế hợp chất hóa học lớp 9
15. Bài tập về phản ứng oxi-hiđro trong hóa học lớp 9


