Bạn đang xem bài viết Bảng tuần hoàn các nguyên tố hóa học đầy đủ nhất tại Thcslytutrongst.edu.vn bạn có thể truy cập nhanh thông tin cần thiết tại phần mục lục bài viết phía dưới.
Tổng hợp bảng tuần hoàn hóa học và dãy hoạt động hóa học của kim loại đầy đủ và chính xác. Tổng hợp đầy đủ về định nghĩa, bảng tuần hoàn, dãy hoạt động hóa học của kim loại cùng ý nghĩa của chúng. Kiến thức bên dưới sẽ giúp hỗ trợ bạn học sinh học hóa được hiệu quả và nhanh chóng hơn.
1) Bảng tuần hoàn các nguyên tố hóa học
a) Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn các nguyên tố hóa học, hay còn gọi là bảng tuần hoàn Mendeleev, bảng tuần hoàn hóa học hay bảng tuần hoàn. Đây là một bảng liệt kê các nguyên tố hóa học một cách khóa học và có quy luật. Bảng được sắp xếp dựa theo số hiệu nguyên tử, cấu hình e. Bảng được sắp xếp theo thứ tự tăng dần có số hiệu nguyên tử. Dựa theo bảng tuần hoàn hóa học, ta có thể xác định được nhóm hóa chất và tính chất cơ bản của chúng.
Dmitri Ivanovich Mendeleev thường xem là người công bố bảng tuần hoàn phổ biến đầu tiên trong 1869. Ông đã phát triển bảng tuần hoàn của mình để minh họa các xu hướng tuần hoàn trong thuộc tính các nguyên tố đã biết khi đó. Mendeleev tiên đoán một số thuộc tính của các nguyên tố chưa biết mà ông hi vọng sẽ lấp vào những chỗ trống trong bảng này. Các tiên đoán của ông tỏ tương đối chính xác khi các nguyên tố gần như phát hiện. Bảng tuần hoàn Mendeleev mở rộng và hiệu chỉnh với sự khám giá hoặc tổng hợp thêm những nguyên tố mới và sự phát triển của các mô hình lý thuyết để giải thích thuộc tính hóa học.
b) Bảng tuần hoàn hóa học
Một bảng tuần hoàn chuẩn sẽ bao gồm 18 cột, 7 dòng và 2 dòng riêng ở cuối bảng. Dưới đây là một bảng tuần hoàn các nguyên tố hóa học chuẩn:

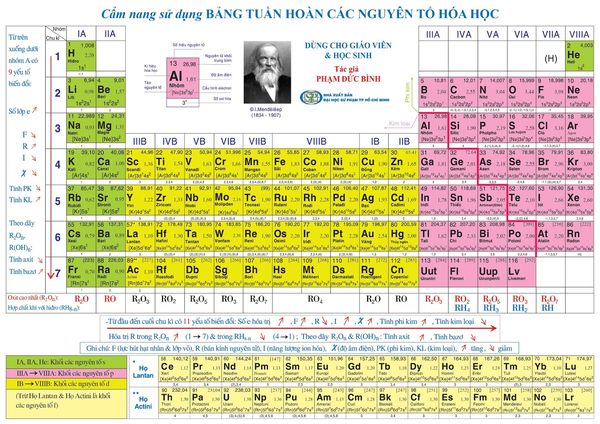
c) Giải thích ý nghĩa bảng tuần hoàn
Trong bảng tuần hoàn, 18 cột tượng trưng cho 18 nhóm nguyên tố thuộc hai nhóm nguyên tố lớn là nguyên tố nhóm A và nhóm B. Việc phân chia này sẽ dựa trên cấu hình e. Nếu cấu hình e của nguyên tố chỉ chứa phân lớp s và p thì đó là nhóm A. Còn nếu cấu hình e của nguyên tố chứa phân lớp d,f thì đó là nhóm B. Trong cùng 1 nhóm nguyên tố (cùng một cột) thì các nguyên tố sẽ có tính chất hóa học tương tự nhau.
Tiếp theo, 7 dòng trong bảng tuần hoàn đại diện cho 7 chu kì. Và 2 dòng riêng ở cuối đại diện cho 2 họ Lantan và Actini. Trên cùng một dòng, các nguyên tử sẽ có cùng số lớp electron. Theo thứ tự từ trái qua, bán kính nguyên tử giảm, năng lượng ion hóa và độ âm điện tăng dần.
d) Nguyên tắc sắp xếp
– Các nguyên tố trong BTH được xếp theo chiều tăng dần của điện tích hạt nhân (từ trái sang phải, từ trên xuống dưới)
– Các nguyên tố có cùng số lớp e xếp vào cùng một hàng (chu kì).
– Các nguyên tố có cấu hình e tương tự nhau được xếp vào cùng một cột (nhóm).
e) Cấu tạo bảng tuần hoàn
Ô nguyên tố:
Ô nguyên tử= Số thứ tự= Số hiệu nguyên tử Z của nguyên tố

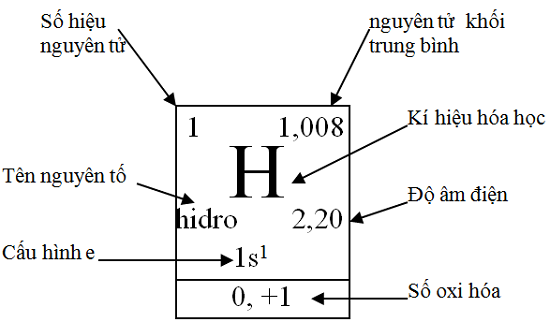
Chu kì:
– Chu kì dãy các nguyên tố mà nguyên tử của chúng có cùng số electron, được xếp theo chiều điện tích hạt nhân tăng dần.
– Bảng tuần hoàn gồm 7 chu kì.
– Chu kì từ 1 đến 3 được gọi là chu kì nhỏ, và từ 3 trở lên được gọi là chu kì lớn.
– Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Các nhóm nguyên tử:

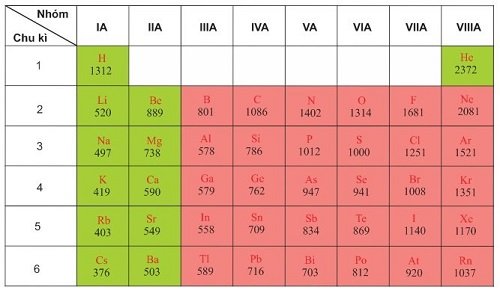
– Nhóm nguyên tố là tập hợp các nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
Phân loại:
Có 2 nhóm đó là nhóm A và nhóm B. Mỗi nhóm được đánh kí hiệu bằng chữ số La Mã kèm theo đó là A hoặc B để biểu thị vị trí nguyên tố đó.
Vd: IA,IIB,…..
– Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
– Nhóm A bao gồm các nguyên tố s và nguyên tố p.
– Khối các nguyên tố d và f gồm các nguyên tố thuộc các nhóm B.
2) Dãy hoạt động hóa học của kim loại
a) Dãy hoạt động hóa học của kim loại là gì?
Đây là một dãy bao gồm các nguyên tố kim loại được sắp xếp theo thứ tự một cách có khoa học. Các kim loại được sắp xếp dựa theo mức độ hoạt động của kim loại. Hay nói cách khác là sắp xếp dựa trên khả năng tham gia phản ứng hóa học của kim loại với các chất khác. Dãy này được xây dựng dựa trên cơ sở thực nghiệm.
b) Dãy hoạt động hóa học của kim loại


c) Ý nghĩa dãy hoạt động hóa học của kim loại
Dựa theo chiều hoạt động hóa học của kim loại, ta có thể xác định được khả năng phản ứng của các kim loại với một số phản ứng hóa học dưới đây:
- Phản ứng với nước: Trong điều kiện bình thương, kim loại Kiềm và một số kim loại Kiềm thổ (như Ca, Ba) tác dụng với nước tạo ra bazơ (hoặc hidroxit lưỡng tính) và giải phóng khí H2, Mg phản ứng chậm và Al không tác dụng được với nước.
- Tác dụng với Oxi: Ở điều kiện thường, kim loại mạnh tác dụng với Oxi. Ở nhiệt độ cao, kim loại trung bình và Cu có thể tác dụng với Oxi.
- Phản ứng với acid: Các kim loại mạnh và trung bình (trừ Pb) đều có khả năng phản ứng với acid sinh ra muối. Tuy nhiên, phản ứng kim loại với acid khá phức tạp và cần nhiều thông tin hơn.
- Phản ứng với dung dịch muối: Kim loại bắt đầu từ Mg trở về sau có thể tác dụng với dung dịch muối của kim loại yếu hơn, tạo muối mới, kim loại mới.
- Khả năng phản ứng với khí CO hoặc khí H2 : Oxit kim loại trung bình (trừ Al) và kim loại yếu bị khử bởi CO hoặc H2 tạo khí CO2 hoặc nước.
- Khả năng nhiệt phân: Các bazơ hoặc hidroxit lưỡng tính không tan trong nước khi được nung nóng sẽ sinh ra oxit của kim loại đó và hơi nước.
d) Một số cách ghi nhớ dãy hoạt động hóa học của kim loại
Ghi nhớ các kí tự riêng lẻ sẽ dễ quên vì vậy mà nhiều câu nói quen thuộc giúp các em ghi nhớ dễ dàng.
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Khi cần nàng may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu
- Khi cả nhà may áo giáp sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Lúc khó bà cần nàng may áo màu giáp có sắt nhớ sang phố hàn đồng hiệu Á Phi Âu.
Xem thêm: 7 hằng đẳng thức đáng nhớ
Hi vọng bảng tuần hoàn hóa học và dãy hoạt động của các nguyên tố kim loại trên đây sẽ giúp ích cho các bạn, hỗ trợ bạn trong việc học hành và thi cử. Còn rất nhiều thông tin học hành bên trong website các em nhớ truy cập vào web ghé xem chi tiết.
Cảm ơn bạn đã xem bài viết Bảng tuần hoàn các nguyên tố hóa học đầy đủ nhất tại Thcslytutrongst.edu.vn bạn có thể bình luận, xem thêm các bài viết liên quan ở phía dưới và mong rằng sẽ giúp ích cho bạn những thông tin thú vị.